Virusähnliche Partikel
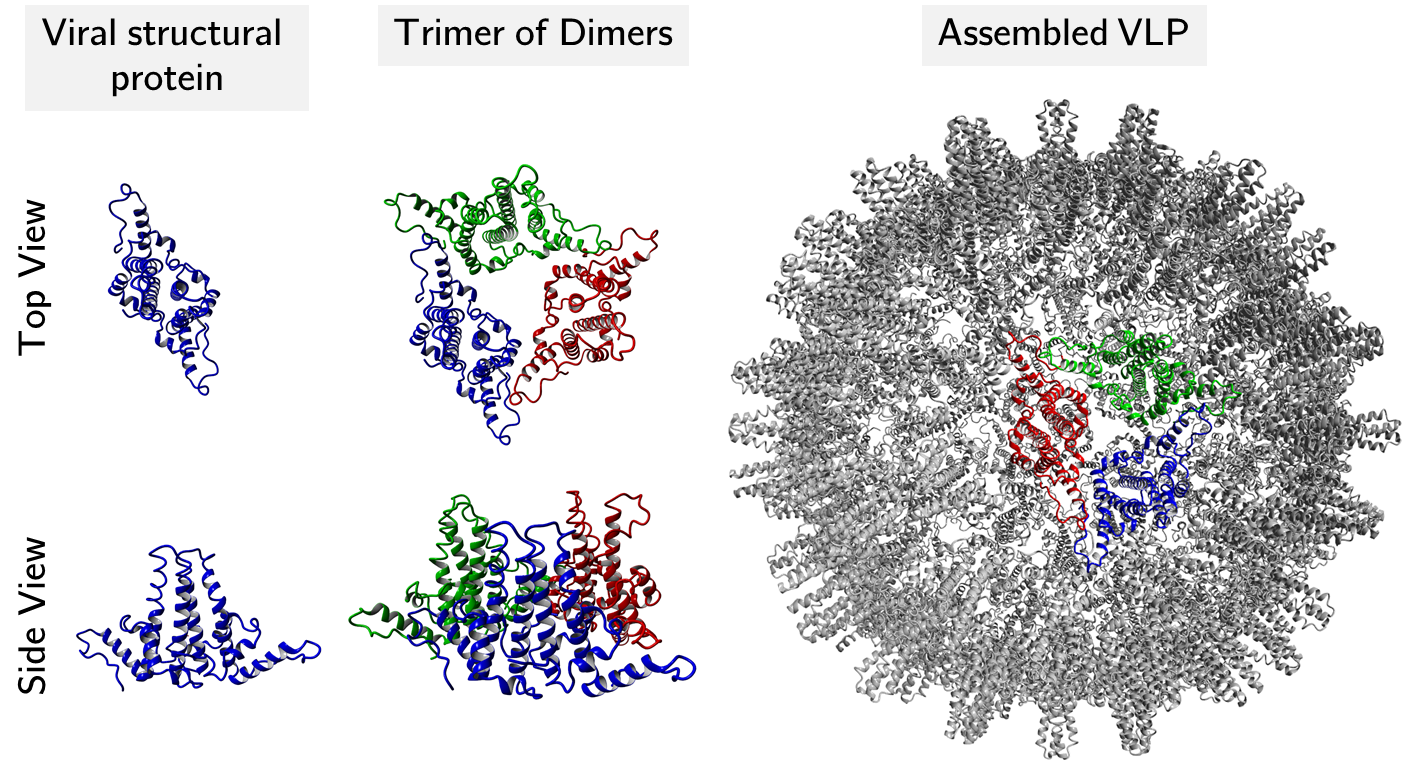
Virusähnliche Partikel (VLPs) bestehen aus viralen Kapsidproteinen, die sich zu makromolekularen, partikulären Strukturen assemblieren. Ihre repetitive und partikuläre Struktur stimuliert das Immunsystem ähnlich wie inaktivierte Ganzvirus-Impfstoffe, ohne das bei letzterem bestehende Restrisiko einer Infektion. VLPs, die fremde Antigene präsentieren, werden als chimäre VLPs bezeichnet. Dies kann z.B. bei der Krebsimmuntherapie, der Immuntherapie der Alzheimer-Krankheit und dem Schutz vor Infektionskrankheiten ausgenutzt werden. Zusätzlich zu ihrer immunologischen Wirkung können VLPs als gezielte Trägerstrukturen für Peptide, Nukleinsäuren und Medikamente eingesetzt werden. Die Verpackung von Nukleinsäuren ist wegen ihrer Nähe zur eigentlichen Funktion des viralen Kapsidproteins (Einschlusskörper für virale Nukleinsäuren) von besonderem Interesse. Im Vergleich zu monoklonalen Antikörpern (mAbs) stellt die Prozessierung von VLPs besondere Herausforderungen, z.B. wegen ihrer deutlich größeren Geometrie. Am Lehrstuhl optimieren wir die Aufreinigung, Prozessierung und das Design von VLPs und genetischem Material. Dabei setzen wir Hochdurchsatzverfahren, prozessanalytische Technik (PAT) und statistische Methoden wie maschinelles Lernen ein.
Literatur
Proteinkonjugation
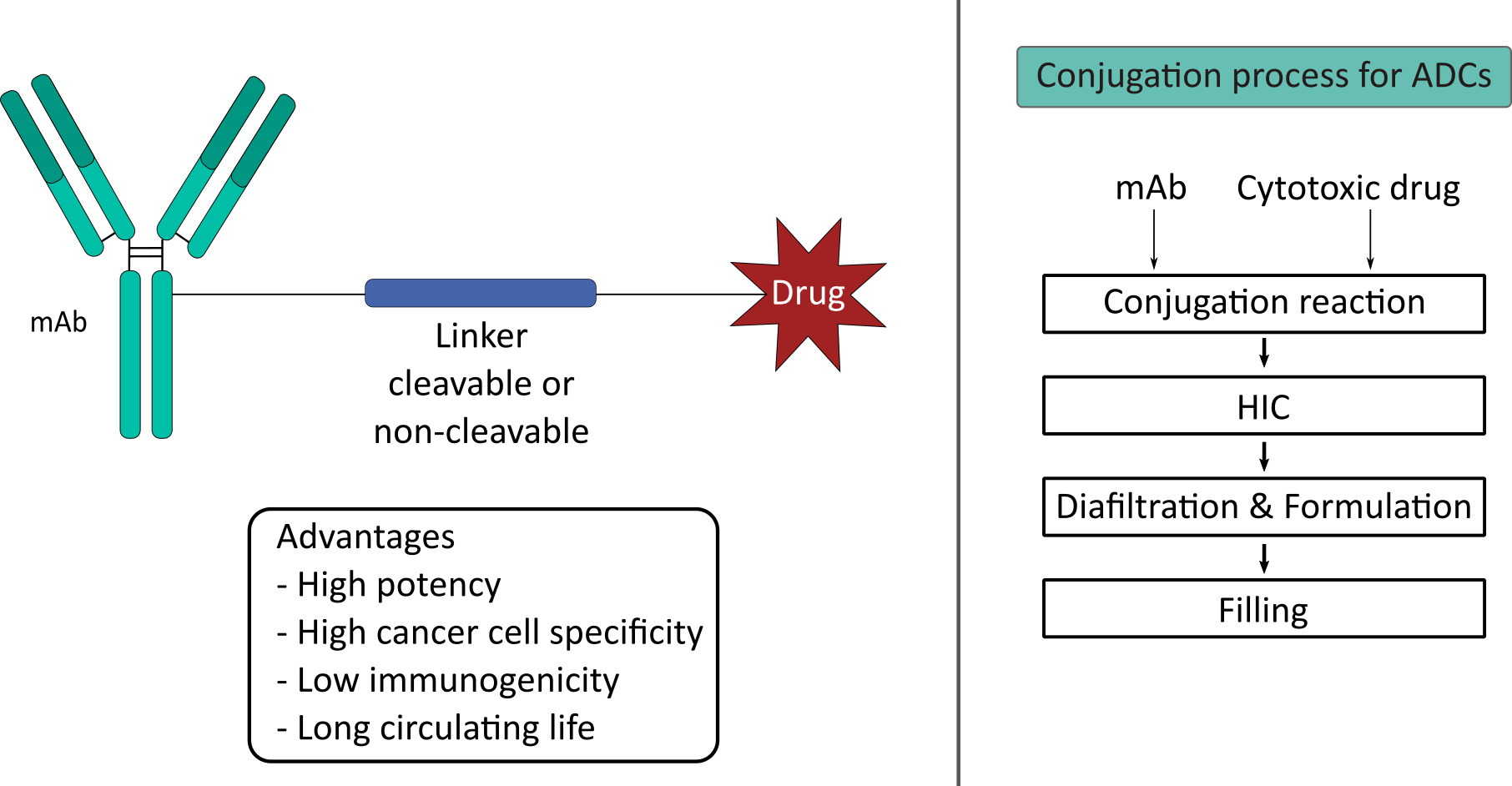
Der Begriff Proteinkonjugation beschreibt die Bindung von nicht-proteinogenen Gruppen an Proteinmoleküle. Das Ziel dieses Verfahrens ist die Herstellung von Molekülen mit einzigartigen Eigenschaften. Die kovalente Bindung von synthetischen Polymeren an pharmazeutische Proteine ist ein Ansatz, physikalische Eigenschaften wie Stabilität, Löslichkeit und Lösungsmitteln-Toleranz zu erhöhen. Weiterhin können physiologische Eigenschaften wie die Halbwertszeit im Körper und die Immunverträglichkeit verbessert werden. Die häufigste Polymermodifizierung in der pharmazeutischen Industrie ist die kovalente Bindung von Polyethylenglykol (PEG) an das Zielmolekül (PEGylierung).
In der Krebstherapie wird auf das Potential sog. Antikörper-Wirkstoff-Konjugate (ADC) gesetzt. In diesem Fall werden biologisch aktive, zytotoxische Medikamente über einen kovalenten Linker an monoklonale Antikörper (mAbs) gekoppelt. Die hohe Spezifität des Antikörpers ermöglicht einen gezielten Transport des Wirkstoffs zu den Krebszellen und schwächt so den systemischen Effekt des Medikaments. Bei der Entwicklung stellt die Komplexität der Reaktionskinetik als auch die Aufreinigung eine große Herausforderung dar. Daher liegt der Schwerpunkt unserer Forschung auf der Prozessentwicklung und -überwachung sowie Anwendung mechanistischer Modelle.
Literatur
Ultra-/Diafiltration
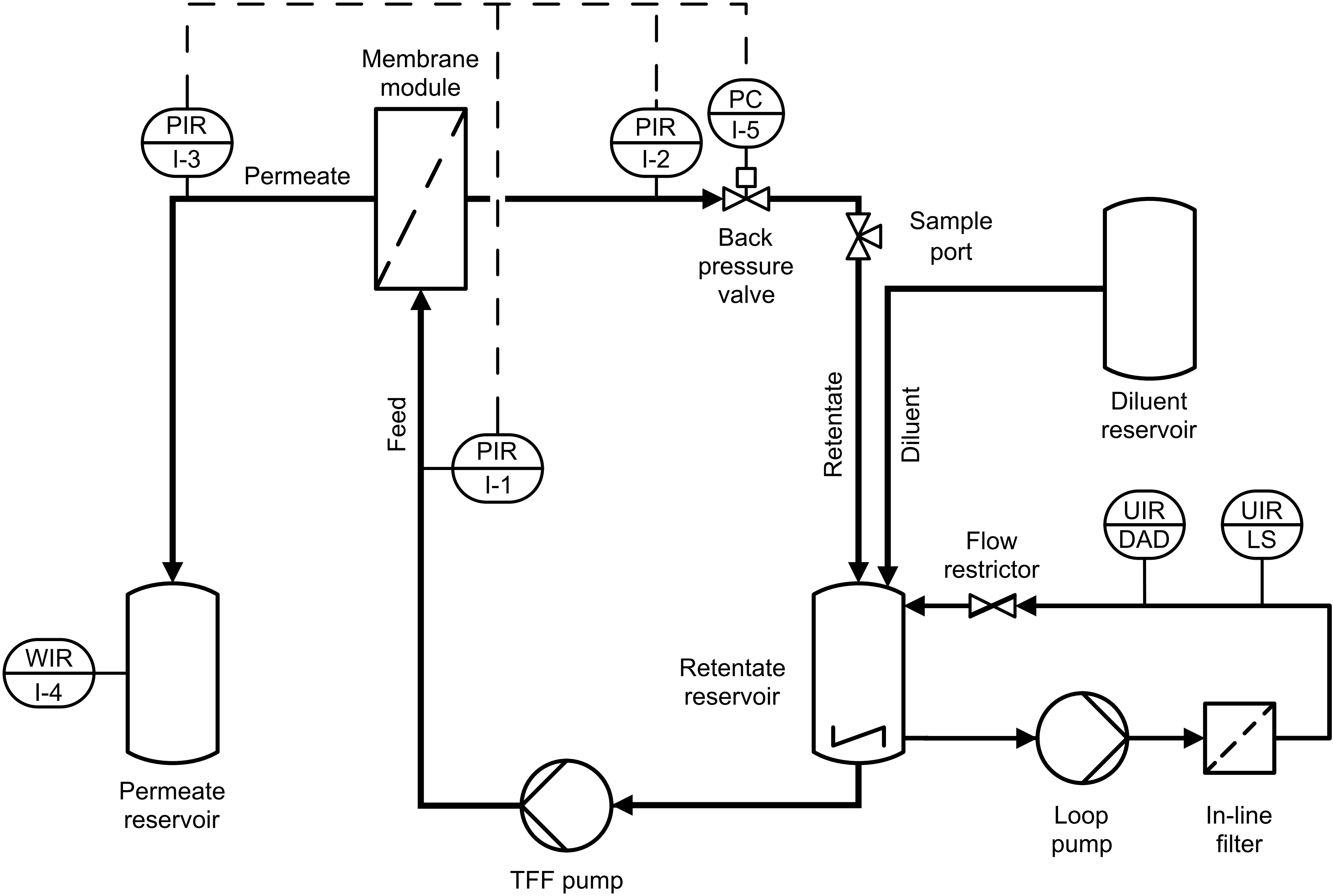
Die Ultrafiltration (UF) und Diafiltration (DF) biopharmazeutischer Proteinlösungen sind Standardverfahren für deren Konzentration bzw. Pufferaustausch. Wir erforschen Prozesse, die über die übliche größenabhängige Trennung von Produkt und umgebender Flüssigphase oder Kontaminanten hinausgehen. Unsere Forschung umfasst I) die produktspezifische Entwicklung von prozessanalytischen Technologien (PAT) mittels verschiedener Sensoren und maßgeschneiderter Software zur Echtzeitüberwachung und -steuerung von UF/DF-Prozessen, II) die Entwicklung integrierter Prozesse durch die Kombination von UF/DF mit anderen Unit-Operations, wie Fällung/Rücklösung, Größenausschlusschromatographie oder biochemischen Reaktionen, und III) die Entwicklung experimenteller Strategien für die mechanistische Modellierung von UF/DF-Prozessen in Zusammenarbeit mit der GoSilico GmbH.
Literatur
Proteinkristallisation
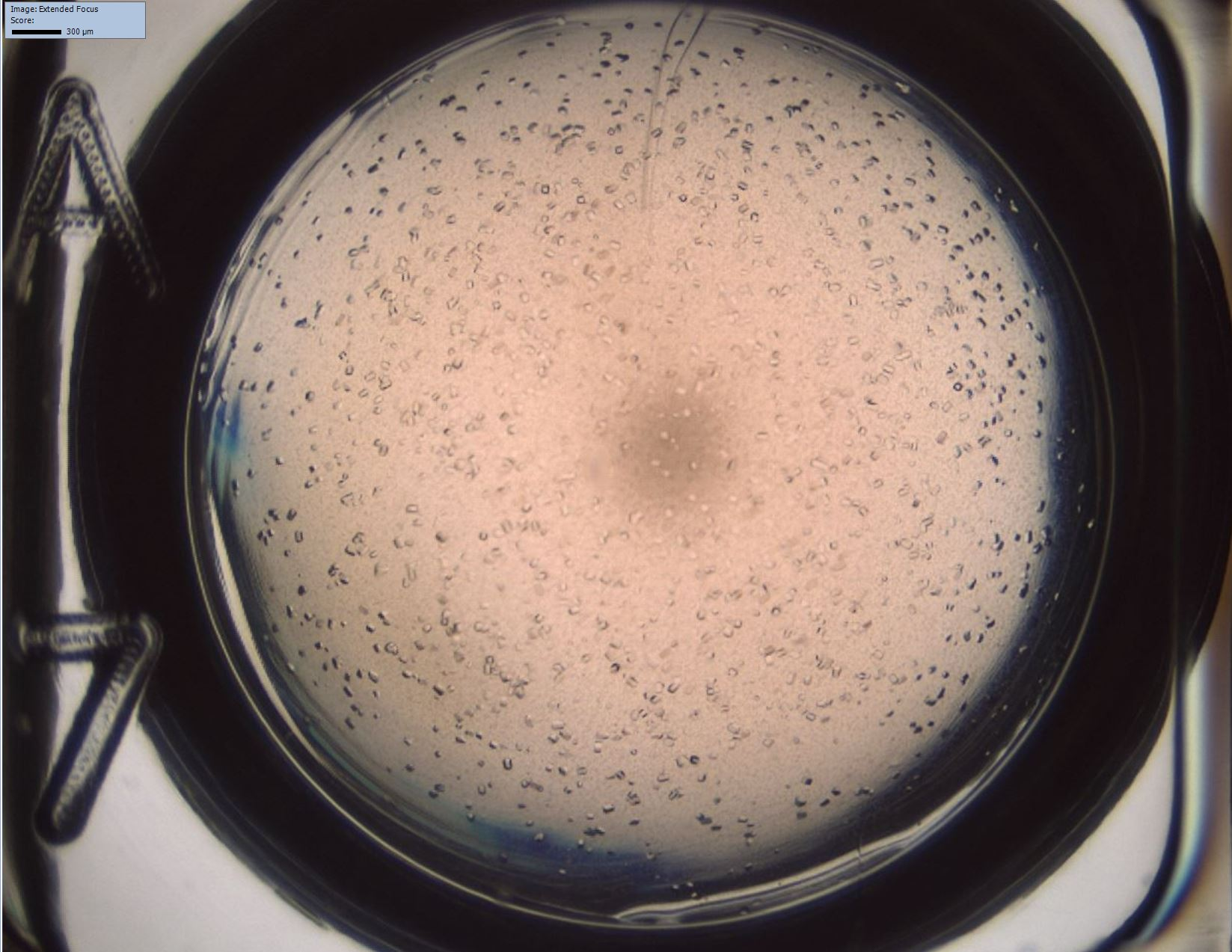
In der biopharmazeutischen Industrie hat sich die großtechnische Proteinkristallisation zu einer interessanten, kostengünstigen Alternative zu herkömmlichen Aufreinigungs- und Formulierungsmethoden entwickelt. Aufgrund der komplexen Mechanismen bei der Kristallisation von Proteinen werden geeignete Lösungsbedingungen empirisch bestimmt. Unerwünschte Aggregation hingegen kann zu Produktverlusten und Veränderungen der dreidimensionalen Struktur des Zielmoleküls führen. Daher ist Wissen über das Phasenverhalten von Proteinen für die Downstream-Prozessentwicklung unabdingbar.
Aus diesem Grund wird an unserem Institut an Hochdurchsatzverfahren gearbeitet, mit denen die Aufnahme von Phasendiagrammen auf einer automatisierten Liquid-Handling-Station im Mikroliter-Maßstab möglich ist. Mithilfe einer hochauflösenden Kamera und automatisierten Überstandsmessungen der Proben kann der Einfluss von Prozessparametern wie Art und Konzentration von Salzen/Polymeren, Temperatur oder pH-Wert auf das Phasenverhalten des Zielproteins aus einem Mehrkomponentengemisch untersucht werden.
Literatur
Andere Themengebiete
Automatisierung und Hochdurchssatzprozessentwicklung
Literatur
Chromatographie
Literatur